
小鼠死亡後屍檢操作程序指南
摘要
小鼠屍檢的主要目(mù)的是通過肉眼觀察確定基因工程小鼠或患病小鼠的解剖特征(zhēng),並描述導致發病率和死亡率的病變。為後續檢查采集的組織需要適當處理和保存,以防止變質。
因此,高效的常規操作對於促進組織學和確保高質量的樣本至關重要。此外,優化技術(shù)最大限度地減少了損壞樣(yàng)本的數據丟失,減少了使用的動物數量,並支持3Rs“reduction”原則。
在本文中,我們提供(gòng)了一種用於(yú)小鼠組(zǔ)織采集的優化方法,也包(bāo)括培訓技巧和注意(yì)事項。
前言
小鼠屍(shī)檢是一種以係統方(fāng)式進行的死後科學檢查,能夠(gòu)觀(guān)察(chá)大體解剖並采集組織,作為實驗終止研究或動物健康篩查的一部分。小鼠屍檢在技術上具有挑戰性,各組操作人員之間的技術差異可能影響數據的可比性。
因此,製(zhì)定一個(gè)標準(zhǔn)化的方(fāng)案和密切監測人員培訓非常(cháng)重(chóng)要,以保持(chí)操作一(yī)致性和采集(jí)的組織質量。簡單的術語表有助(zhù)於確保操作者之間的(de)描述的(de)一致性。
本文中的方法平均需要2個小時左(zuǒ)右就可以(yǐ)掌握,如果熟練操作,10分鍾左右就能夠(gòu)完成1隻(zhī)小鼠(shǔ)的解剖操作。在操作組織或化學試劑時,需要佩戴適宜的PPEs(防護眼鏡、手套、白大褂和口罩等)。
注(zhù)意:在解剖實驗(yàn)動物前,必須進行(háng)培訓以掌握解(jiě)剖(pōu)技巧。
解剖前準備
本文所描述的解剖操作是在兩隻16周齡的B6J小鼠(shǔ)(雌雄各1隻)上進(jìn)行的。其飼養(yǎng)條件為:IVC飼養,自由采食飼料和飲水(shuǐ),符合動物福利。
如果需要生化檢測以(yǐ)補充大(dà)體觀察,在解剖(pōu)前(qián)可(kě)進行終末采血(全身麻醉後(hòu)進行)。一(yī)旦采(cǎi)集了(le)所有必要的(de)樣本,必須對小鼠進行放血或使(shǐ)用其他安樂死方法。采血操作人員必須經過培訓。
采集後的組織置(zhì)於10%中性緩衝(chōng)福爾馬(mǎ)林溶液中(10% neutral buffered formalin下文簡稱:10% NBF),除非(fēi)有其他(tā)要求。一些組織可以放置在無纖維吸墨紙上,以避免折疊,並(bìng)便於在包埋和顯微分析時定位。
提示:10% NBF需要(yào)預先準備好(hǎo),對大(dà)多數組織具有良好的固定效果,理想的固定液(yè)與組織的(de)比例至少為20:1。固定(dìng)液體積不足會(huì)導致固定效果不良。
小鼠解剖具(jù)體步驟
對小鼠實(shí)施安樂死。在確認小鼠死亡(wáng)後(即血(xuè)液循環停止),在解剖前應用70%的酒精浸濕毛皮,以降低過敏原風險。
穿過腹側皮(pí)膚和腹肌,穿過胸腔的(de)尾(wěi)緣,在劍骨下方(圖1-A和1-B),做一個腹部切口。
然後從兩側向恥骨方向切開腹部,然後穿(chuān)過尾腹,切除整個腹側皮膚。切下的腹(fù)部皮膚(fū)部分(fèn)平鋪在(zài)一張紙上(圖1-C)。
√提示:確保切除的(de)腹部皮膚部(bù)分足夠寬,並包含乳(rǔ)腺組織。
使用26G 3/8針頭和(hé)5ml注射器吸取10% NBF對腸道和胃部組織進(jìn)行灌(guàn)注(zhù)(圖1-D),以(yǐ)減少自溶,因為小(xiǎo)鼠死亡後腸內迅速發(fā)生自溶。
√注意:灌注要適量,否則腸道過度膨脹可能導致破裂或過度拉伸。
然後(hòu)摘下胃腸道(dào)。輕輕按住胃(wèi),剪斷食道,剝離腸(cháng)道。剪斷骨盆附近的結腸,盡可能(néng)完整的取下(xià)整個胃腸道。
√提示:抬高小鼠軀(qū)體可以使胃腸(cháng)道遠離腹腔,減少剪斷結腸時損傷其(qí)他組織的風(fēng)險。
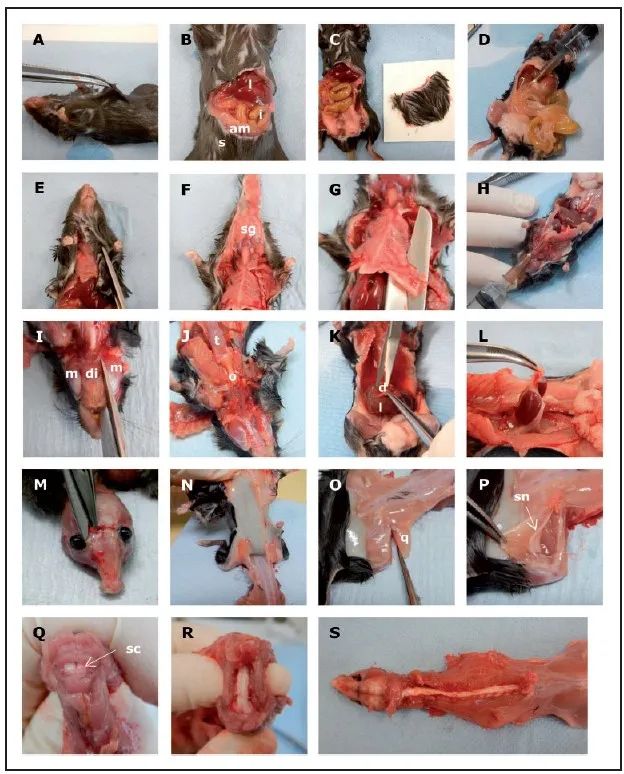
圖1 (A-S)小鼠屍檢
(am:腹肌(jī);d:膈肌;di:二腹(fù)肌;i:腸道;l:肝髒;m:咬肌;o:食(shí)管;q:股(gǔ)四頭肌(jī);s:皮膚;sc:脊髓;sg:唾液腺;sn:坐骨神經;t:舌頭)
小心剪開肋弓到下頜骨的皮膚(fū),以減少對唾液腺和氣管造(zào)成損傷(圖(tú)1-E)。下頜骨唾液腺附(fù)著在皮膚(fū)上(圖1-F)。
接(jiē)下來(lái),從靠(kào)近前肢的兩側切開胸骨和肋骨,並穿過兩側鎖骨(圖1-G)。
√提示:剪(jiǎn)刀的一個刀片應該插入胸(xiōng)骨上切口,另一個(gè)刀片(piàn)插入肋骨和鎖骨外側,避免損傷胸腺(xiàn)或心髒。注意:避免損傷胸骨,因為胸骨可用(yòng)於(yú)評估骨髓。
使用26G3/8針(zhēn)頭通過氣管緩慢(màn)向肺部灌注NBF(圖1-H)。
√注意:避免多次穿孔氣管(guǎn),因為這會損傷組織。提示:為了有效進行(háng)肺部灌注,可以將針頭彎曲成90度或保定小鼠頭部,以形成(chéng)合(hé)適的針(zhēn)頭插入角度(dù)。
依次(cì)取下舌頭、下頜骨(gǔ)、甲狀腺(xiàn)、氣管、食道、心髒、胸腺和肺。切斷二(èr)腹肌和咬肌之間的下頜骨,並輕輕摘取組織器官(圖(tú)1-I和1-J)。
一並取下肝髒和膈肌(jī)(圖(tú)1-K),操(cāo)作肝髒時要(yào)輕柔,因為肝髒易(yì)碎。
通過提拉輸尿管並切斷(duàn)背側連接,取下雙腎及(jí)其相伴的(de)腎上腺(圖1-L)。
如果是雄性動物,取下兩個睾丸並放入Hartmann’s固定液中。解剖兩個附睾並平放在紙上。將(jiāng)精囊、前列腺和膀胱整體切除,平放於紙上(圖2-A至2-D)。
√提示:對於眼睛(jīng)和睾丸(wán)等組織,使用Hartmann’s固定液(改良戴維(wéi)森)(Cat. H0290-500ML; Merck Life Science)可減少組織收縮和確保足夠的固定(dìng)。
樣品應在室溫下固定24-72小時(shí),然後轉移到(dào)10% NBF中。
如果是(shì)雌性動物,應切開恥骨,從卵巢到陰道(dào)口處,整個切除雌性生殖道,(圖2-E至(zhì)2-H)。一並取下膀胱,但不包括結腸,然後放置在紙上。
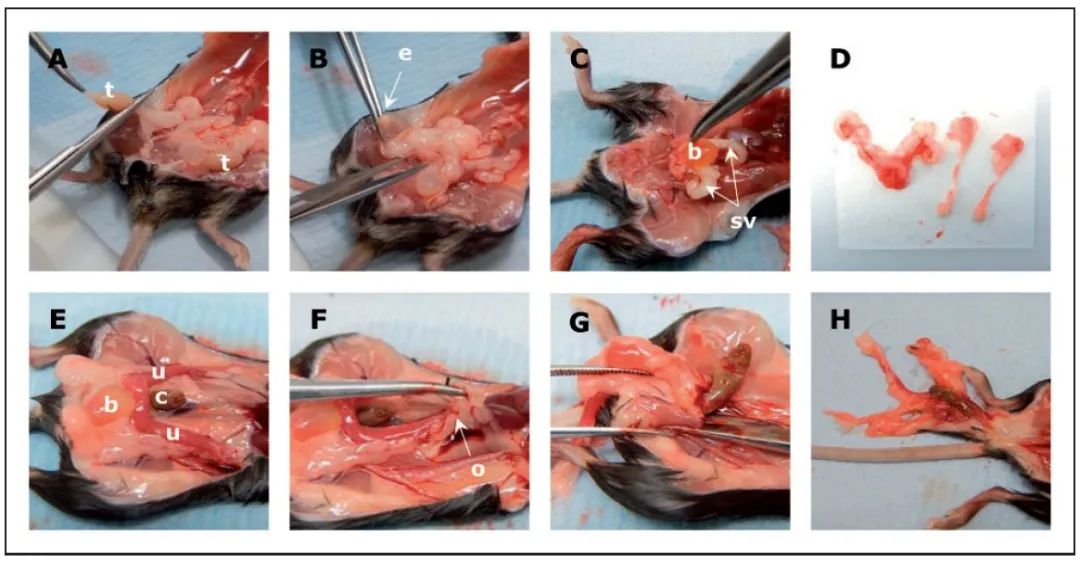
圖2 生殖道解剖,雄鼠(A-D),雌鼠(E-H)。
(b:膀胱;c:結腸;e:附睾;o:卵巢;sv:精囊;t:睾丸;u:子宮角(jiǎo)。)
剝去顱骨處的皮膚,並在眶間切開顱骨(圖1-M),以允(yǔn)許固定劑能夠滲透(tòu)進大腦。雙眼應連同視神經一起切除並放入(rù)Hartmann’s固定液中。
剝離從肩部到尾根(gēn)部的皮膚,去除皮下組織,鋪(pù)平放在紙上(圖1-N)。
從一側後肢沿股骨切取股四頭肌(圖1-O)。通過分割股二頭肌暴露坐(zuò)骨神經,取出(chū)並放在紙上(圖1-P)。
√注意:盡量減少對坐骨神經的操作,因為它很容易損(sǔn)傷。
髖關節處取下剩餘的後肢和(hé)後爪。這(zhè)個樣本包含膝關節,可以脫鈣進(jìn)行組織學檢查。
從寰枕間隙開始,切除兩側椎弓,並切除和收縮背(bèi)突,使脊髓暴露至腰(yāo)椎區域(圖1-Q和1-R)。胴體放置在10%的NBF中(圖1-S),並固定至少24小(xiǎo)時。
√提示:脊髓暴露是操(cāo)作中最具技術挑戰(zhàn)性的部分。我們建議使用彎曲的和/或直(zhí)的彈簧剪刀和胴體定位(平放在解剖台上或彎曲在手上),以(yǐ)減少對組織的張力。
總結
這種快(kuài)速完整的(de)小鼠屍檢方(fāng)法可以(yǐ)保存小鼠的所有組(zǔ)織,並最大限度地從單個標本中獲得數據。雖然必須考慮到物(wù)種之間的差異(yì),但這種方法很容易在大鼠、倉鼠、兔子等物種上複製。
不同的固定劑(jì)也可以(yǐ)用於滿足特定(dìng)的研(yán)究需要。組織可以保存在福爾馬林中,或者在最短的固(gù)定時間後,可以(yǐ)修剪、加工、石蠟包埋、切片並染色進(jìn)行組織學(xué)分析(xī)。
注意,任何骨樣本在(zài)包埋前都必須脫鈣,以使其更容易(yì)切割和避免破碎。
參考資(zī)料:
1.A guide to post-mortem examination procedure in mouse models,Alexandra Rodrigues1, Lynn Beresford1, Cheryl L Scudamore etc,Laboratory Animals 2022, Vol. 56(5) 466–470


